Détails du sujet
Cours Acides aminés
--
Toutes les cartes
Par quelles types de liaisons les AA sont-ils reliés au sein d’un peptide/protéine?
Liaisons peptidiques de types amide (CO-NH)
Comment séparer les AA entre eux ?
Hydrolyse chimique ou enzymatique
Quels sont les autres noms des AA
AA carboxyliques, Acides amino-carboxyliques, Aminos-acides
Combien y a t’il d’AA protéinogènes
20 + 2
Quels sont les 2 nouveaux AA protéinogènes
- Sélénocystéine (EU + PRO)
- Pyrrolisine (PRO)
Implication de la sélénocystéine
Entre dans la composition de la thiorédoxine réductase et de la désiodase (qui entrent en compte dans le métabolisme des hormones thyroïdiennes)
De qui dérive la sélénocystéine ?
De la sérine (Sélénium remplace Oxygène). Elle ressemble métaboliquement à la cystéine.
Implication de la Pyrrolysine
Entre dans la composition de la méthyltransférase
Pourquoi dit-on que la fonction amine de la proline est secondaire ?
Fonction amine primaire : Azote relié à 2H et à C alpha.
Pour la Proline : son azote est lié à 2 carbones (C alpha et C beta) et 1H.
Quel groupement est responsable des propriétés physico-chimiques d’un AA ?
Le groupement R
Combien d’AA ont 1 C*, 2 C*, 0 C*
17 AA avec 1 C*
2 AA avec 2 C* (Thréonine T, Isoleucine Ile)
1 AA sans C* (Glycine)
Comment appelle-t-on un AA dont l’amine porté par le C alpha est D (dextra)
D si C beta est L
D-allo si C beta est D aussi
A quelle règle D/L de Dextra et Laevus font-ils référence ?
Convention de Fisher
A quelle règle D/L de Dextrogyre et Levogyre font-ils référence ?
Principe physique du pouvoir de rotation.
AA qui réfléchi la lumière à Droite = D
AA qui réfléchi la lumière à Gauche = L
De quel type (Dextrogyre/Levogyre) les AA de nos cellules vivantes sont-ils ? Et les mortes ?
Vivantes = L (life)
Mortes = D (dead)
Comment dater une mort cellulaire ?
Rapport AA L/ AA D.
Quels sont les AA pouvants être présents dans la paroi bactérienne ? Quelles en sont les conséquences ?
D-alanine (Ala, A)
D-glutamine (Gln, Q)
Insensibilité à la L-peptidase humaine
Quels sont les AA à radicaux aromatiques ? Qu’absorbent-ils ?
Ils absorbent les UV
Phénylalanine (F) = 257 nm
Tryptophane (W) = 280 nm
Tyrosine (Y) = 275 nm
En quoi cette absorbance est-elle utile ?
- Dosage d’une solution avec Loi de Beer -Lambert
- Détermination de la pureté d’une solution d’acide nucléique contenant des protéines avec ces AA à radical aromatique
260nm (absorbance nucléique)/280nm (absorbance protéique)
Si rapport > 1,8 = pureté.
Quels sont les 7 rôles principaux des AA non protéinogènes ?
- Précurseurs de mol. Complexes
- Précurseurs de médiateurs cellulaire
- Précurseurs hormonal
- Réserve d’énergie
- Neurotransmetteurs
- Rôle dans le métabolisme
- Production de monoxyde d’azote
Exemple Précurseurs de molécules complexes
Glycine : entre dans la compo de l’hème et de la globine
Exemple Précurseur de médiateurs cellulaire
Histidine : précurseur de l’Histamine
Exemple Précurseur hormonal
Tyrosine iodée donne :
MIT : Mono-iodotyroSine
DIT : Dio-iodotyroSine
Qui donnent des hormones thyroïdiennes :
MIT + DIT : Tri-iodotyroNine
DIT + DIT : Tétra-iodotyroNine
Dextrogyre (+ ou - ) ?
Levogyre (+ ou -) ?
Dextrogyre +
Levogyre -
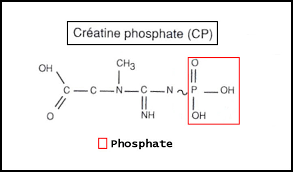
Exemple de Réserve d’énergie
La Créatine-phosphate contient une liaison énergétique type phospho-amidine
Exemple de Neurotransmetteurs
(-) Glycine, GABA (Acide Gamma Amino-Butyrique, dérivé du glutamate)
(+) Glutamate
Exemple de Rôle dans le métabolisme
AA glucoformateurs (néoglucogenère)
AA impliqués dans le transport et l’élimination de l’azote
Combien existe-t-il de rôles non protéinogènes ?
300 (dont certains font parti de la liste des 20)
Qu’est ce que le pK du groupe ionisable
pH pour lequel le groupe est à 50% ionisé.
Donc pKa (pour ionisation de type COO-) et pKb (pour ionisation de type NH3+)
Qu’est-ce que le point isoéléctrique pHi
pH pour lequel la somme des charges intramoléculaire est nulle.
Si pH=pHi alors AA neutre = pKa + pKb / 2
(on divise par 2 car on a 2 pK)
Décrire le processus de l’éléctrophorèse d’un AA
1. Dépôt des AA en solution sur un support d’acétate de cellulose
2. Migration des AA, anions (-) vers anode (+), cations (+) vers cathode (-).
3. Révélation de la position des AA grâce à une coloration à la ninhydrine
Principe de la chromatographie échangeuse de cations (anionique)
- Préparation d’une solution aqueuse avec pH<pHi des AA contenus, qui sont donc sous forme NH3+/COOH.
- Dépôt de la solution dans un tube contenant une résine polysulfonnée (SO3- + Na+) avec SO3- fixe.
- Le NH3+ des AA se fixe au SO3- en remplaçant Na+
- Augmentation du pH pour que pH=pHi puis pH>pHi pour l’un des deux AA (celui donc le pHi est le plus faible) , ou augmentation de sel (NaOh, NaCl...).
- L’espèce d’AA avec le pHi le plus faible se transforme alors en NH2-COO-, les AA se détachent.
Quels sont les deux types de résine, et faut-il augmenter ou diminuer le pH pour modifier la charge des ions ?
- Résine Polyaminée (cationique) : Fixe les AA si pH > pHi (donc les anions) / Il faut diminuer le pH.
- Résine Polysulfonée (anionique) : Fixe les AA si pH < pHi (donc les cations) / Il faut augmenter le pH.
Combien y a t’il d’AA apolaire ? Polaire chargés ? Polaire non chargé ?
Apolaire : 9
Polaire chargé : 5
Polaire non chargé : 6
Comment appelle t-on le type d’AA qui possède un amine secondaire ?
Alpha-iminoacide
Acide alpha-iminé
Comment se présente l’AA si pH<pHi ?
Fonction NH3+ et COOH
Comment se présente un AA dont pH>pHi
Fonctions NH2 et COO-
Qu’est-ce que l’hyperglycinémie sans cétose ?
Glycine plus dégradée à cause d’une maladie métabolique du complexe protéique P, T, H, L.
Augmentation de glycine dans les urines, le sang, le LCS.
Diminution de la concentration de serine dans le sang
Prévalence Hyperglycinémie sans cétose
A à 9 cas pour 1 million de naissances
La différence de configuration stéréo-chimique entre un AA Dextra et un Laevus entraîne t-elle des différences dans le propriétés physico-chimiques ?
Oui, seulement pour la déviation de la lumière. Mais un Dextra ne sera pas forcement Dextrogyre et un laevus ne sera pas forcement Levogyre
Quelles sont les conséquences biologiques du fait que les AA soit amphotères ? De quelle catégorie de conséquence s’agit-il ?
Conséquence physiologique au niveau cellulaire
Les AA ionisés vont permettre la formation de liaisons électrostatiques.
Principe de la chromatographie échangeuse d’anions
- Préparation d’une solution dont pH>pHi des AA présents qui sont donc sous forme NH2-COO-.
- Dépôt de cette solution dans un tube contenant une résine polyaminées (NH3+ / Cl-), avec NH3+ fixes.
- Les AA se fixent tous à NH3+ et Cl- se détache.
- Diminution du pH de la solution > les AA de l’espèce dont le pHi est le plus fort vont devenir NH3+/COO- puis NH3+/COOH. On peut aussi augmenter la quantité de sel.
- Ces AA se détachent de la résine, les autres restent.