Details for a topic
Chimie Générale (Rappels)
--
All cards
Explications structure lacunaire
R(atome) = 100 000 x R(noyau)
Nuage électronique très éparpillé
Nucléide déf.
Atomes ayants le même A (nombre de masse, protons + neutrons) ou le même Z (protons)
Isotopes déf.
Nucléides ayants le même Z
Isotones déf.
Atomes ayants le même nombre de neutrons (A-Z)
Isobares déf.
Nucléides ayants le même nombre de masse A (nucléons)
Isoélectroniques déf
Atomes ayants le même nombre d’électrons
Nombre d’élements chimique
118
Nombre d’éléments chimiques naturels (quels sont-ils ?)
90 (92 - 2)
Les éléments sont naturels jusqu’au 92ème (inclut)
Sauf : Technéthium (43) / Prométhium (61)
Unité de la masse atomique relative
Aucune
Unité de la masse molaire
Atome : uma
Element : g.mol-1
Différence masse molaire atomique d’un atome / d’un élément
La masse molaire atomique de l’atome ne prend pas en compte dans son calcul les différentes proportions des masses des différents isotopes de l’élément.
Formule permettant de trouver le nombre de moles à partir de la masse étudiée et de la masse molaire de l’élément.
n = m/M
Formule permettant de trouver le nombre de moles à partir du nombre d’avogadro et du nombre d'entités
n = N / Na
Sachant que Na est exprimé en mol-1
Que représentent les orbitales dégénérées ?
Ce sont des orbitales ayants le même niveau d’énergie (c’est à dire appartenants à la même sous-couche p, d...)
Equivalence uma (u) et g.mol-1
1 uma = 1g.mol-1
Mais ils n’expriment pas la même chose :)
Calcul du nombre d’orbitales dans une couche
n^2
Nombre de sous couche dans une couche
= numéro de couche n (1,2,3,4,5,6...)
Nombre d’orbitales dans une sous-couche
2l+1
(2 x (0 à 3))+ 1
Forme des orbitales s
Sphérique
Forme des orbitales p
Bi-lobées
Forme des orbitales d
Forme complexe à 4 lobes
Principe d’exclusion de Pauli
Dans un atome, deux électrons ne peuvent avoir leurs quatre nombres quantiques identiques.
Par conséquent, une OA contient au maximum 2 électrons différenciés par leur nombre quantique de spin.
Règle de Hund
A l’état fondamental, il est absolument nécessaire d’occuper le maximum d’orbitales de même énergie (dégénérées) avant d’apparier les électrons deux à deux.
« Hund électron, puis Dos »
Que signifie les 3 nombres quantiques principaux
1. n = couche électronique (1,2,3,4,5,6...)
2. l = sous-couche électronique (l= 0 ou s, l=1 ou p, l=2 ou d, l=3 ou f).
3. Ml = orientation de l’orbitale (-2, -1, 0, 1, 2)
Nombre quantique de spin
Ms, noté +1/2 ou -1/2
Orientation de l’électron
Liste des gaz rares
HE NEron, ARrête de KRâner XEnophobe RiNgard !
Helium(2), Néon(10), Argon(18), Krypton(36), Xénon(54), Radon(86)
Quelles sont les irrégularités de remplissage ?
4 irrégularités jusqu’à 55 puis après beaucoup à ne pas connaître nécessairement .
24 (Chrome) et 42 (Molybdène) = ns1 puis (n-1)d5
29 (Cuivre) et 47 (Argent) = ns1 puis (n-1)d10
Ordre de retrait de la configuration électronique lors d’une ionisation
On démarre toujours par la couche la plus externe, même si la couche inférieure n’est pas remplie.
Ex : 3p6, 4s2, 3d2 devient 3p6, 3d2
Nombre de colonnes des parties s, puis p, puis d de Mendeleiev
2, 6, 10
Deux isotopes peuvent-ils avoir un symbole chimique différent ?
Non, car chaque élément chimique est caractérisé par son Z
Donner la définition d’une mole
Une mole correspond à une quantité égale au nombre d’atomes présents dans 12 g de C12 soit 6,02214x10^23 (Na)
A quoi correspond l’unité de masse atomique (u) par rapport au Carbone 12 ?
1/12 de la masse d’un atome de Carbone 12
Difference entre géométrie d’une molecule et sa figure de repulsion ?
Géométrie : agencement des atomes autour de l’atome central
Figure de répulsion : agencement des electrons autour de l’atome central
Comment calculer la masse d’un atome de carbone ?
12g (masse d’une mole) / Na (nombre d’atomes dans la mole) = 1, 99269. 10^(-23) g
A quoi correspond Na pour une entité quelconque ?
Au nombre d’entités présentent dans une mole de cette meme entité
Règle de Klechkowski
Remplissage des OA par ordre croissant d’énergie
Liste des Halogenes
F, Cl, Br, I, At
Liste des alcalins
H, Li, Na, K, Rb, Cs, Fr
Definition liaison de coordinance
Liaison forte caractérisée par la mise en commun de deux electrons de la part d’un meme atome, afin de remplir l’orbitale atomique vide de l’autre atome
Comment calculer la charge formelle d’un atome au sein d’une molecule
Ch.f = nombre d’electrons de valence - doublets liants - (2x doublets non liants)
Comment expliquer la mésomérie ?
Fait qu’une molecule ait diverses representations (modifications des charges formelles, déplacement des doublets non liants et des doubles liaisons)
Puisque la molecule a plusieurs possibilités d’arrangements électroniques (pour permettre les liaisons de coordinance ou covalentes)
De quoi depend l’énergie de liaison ?
- Des atomes impliqués
- Du nombre d’électrons impliqués (liaison simple, double, triple)
- De l’environnement de chaque atome
Quand est-ce que la géométrie de la molecule est égale a sa figure de repulsion ?
Lorsqu’il n’y a pas de doublets non liants autour de l’atome central, que les atomes sont tous de meme nature
A quelle géométrie une hybridation sp du carbone correspond elle ?
- Réarrangement électronique avec nouvelle sous couche sp
- Carbone divalent
- Géométrie linéaire
A quelle géométrie une hybridation sp2 du carbone correspond elle ?
- Réarrangement électronique avec nouvelle sous couche sp2 contenant 3e-
- Carbone trivalent
- Géométrie triangulaire, trigone plan
A quelle geometrie une hybridation sp3 du carbone correspond elle ?
- Réarrangement électronique avec nouvelle sous couche sp3 contenant 4 e-
- Carbone tetravalent
- Géométrie tétraédrique
Comment se présente la géométrie de différents
mésomères
La géométrie varie selon le mésomère car il y a déplacement des doublets non liants et des liaisons multiples notamment
Quelle particularité d’orientation les atomes impliqués dans une délocalisation électronique au sein de mésomères présente-ils ?
Ces atomes sont dans le meme plan
Dans quelle cas une liaison est polarisée ?
Si elle concerne deux éléments différents, puisque l’un sera plus électronégatif que l’autre
Caractéristiques du vecteur moment dipolaire
- Sens : + vers - (du moins chargé car moins electroneg. vers plus chargés car plus electroneg.)
- Direction : colinéaire à la liaison
- Norme : 4,8 x delta des électronégativités x distance ente les deux atomes
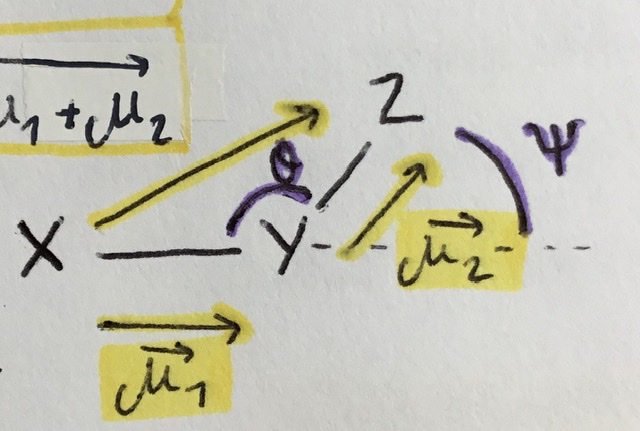
Comment calculer le moment dipolaire d’une molecule ?
Il faut exploiter deux à deux les liaisons.
Formule : (à partir relation de Chasles)
√A² - 2ABcos(angleX/Z) +B²
√A² + 2ABcos(angleY/Z) +B²
Avec A = moment dipolaire entre les atomes X et Y et B = moment dipolaire entre les atomes Y et Z
Une molecule avec figure de repulsion parfaite présente elle un moment dipolaire ?
Non car pas d’attraction vers atome en particulier
Sous quelle forme se trouvent les molecules a temperature ambiante ?
Solide, liquide ou gazeux. Leur état change selon la formation ou destruction des liaisons faibles les structurants
Sous quelle forme se trouvent les composés métalliques, les composés covalents, et les composés ioniques à température ambiante ?
Solide car la destruction de leurs liaisons de structure demande un apport d’énergie bien plus important (leur état ne dépend pas de liaisons faibles)
Quelle sont les liaisons faibles et l’énergie qui leur est associée
- Liaisons hydrogène 2 à 60 kJ/mol
- Interactions de Van der Waals 0,05 à 40 kJ/mol
Qu’est-ce que la Force de London ? A quelle énergie cette liaison est-elle associée ?
E : 0,05à 40 kJ/mol
Une molecule apolaire présente un dipôle instantané et provoque un dipôle induit chez une autre molecule apolaire
Qu’est ce que la Force de Keesom ? Quelle énergie est liée à cette liaison ?
Deux dipôles permanents s’attirent et forme une liaison faible de 5 à 25 kJ/mol
Qu’est ce que la Force de Debye ? Quelle énergie est liée à cette liaison ?
E : 2 à 10 kJ/mol
Deux possibilités :
- Un dipôle permanent polarise une liaison apolaire, qui devient donc dipôle induit ;
- Deux dipôles permanents augmentent leur moment dipolaire en se rapprochant l’un de l’autre.
Difference entre changement d’état et décomposition chimique
Changement d’état : casse liaisons faibles
Décomposition : casse liaisons fortes / covalentes
De quelles liaisons faibles les helices d’ADN sont elles composées
Liaisons hydrogène liants les bases puriques (double cycle, A et G) aux bases pyrimidiques (simple cycle U, C, T)
De quelles liaisons faibles les macromolecules biologiques (comme les protéines) sont elle formées ?
- Pont disulfure (fonction thiol de la cysteine)
- Liaisons hydrogène
- Effet de London
Comment fonctionnent les liaisons des composés métalliques ?
Noyaux des métaux immobiles, mais grande capacité à céder des électrons donc creation d’un gaz d’électrons assurant la cohésion.
Autre nom des liaisons métalliques
Les liaisons communautaires
Quelles sont les propriétés physiques des composés métalliques ?
- Tres bon conducteurs
- Deformable (gaz = lubrifiant)
Comment se forme une liaison ionique ?
Atome métalliques + atome non métalliques avec une différence d’electronegativite supérieure ou égale à 1,8
Les liaisons ioniques sont elles fortes ou faibles ?
Forte
Energie d’une liaison hydrogène
2 à 60 kJ par mole
Quelle énergie est associée aux ponts disulfure ? De quel type de liaison s’agit-il ?
Ponts disulfure = liaison covalente
(fonction thiol de la cystéine) Env 200 kJ/mol
Phrase permettant de retenir l’ordre des 3 interactions de Van der Waals ?
Keesom nous Debye pour ne pas aller à London ?